-
게시판-관련소식
뉴스레터 2024년 9월호
2024-09-25 by ISPE Korea
-
MFDS 소식
「의약품 등의 안전에 관한 규칙」 일부개정령(안) 입법예고
식품의약품안전처공고 제2024-403호
「의약품 등의 안전에 관한 규칙」 을 개정하는 데에 있어, 그 개정이유와 주요내용을 국민에게 미리 알려 이에 대한 의견을 듣기 위하여 「행정절차법」 제41조에 따라 다음과 같이 공고합니다.
1. 개정이유
의약품 제조업자 등이 품목허가 당시 제출되었던 임상시험자료를 근거로 일정기간 동안 새롭게 의약품의 품목허가를 신청하거나 품목신고를 할수 없도록 하며, 의약품 신약등의 재심사 제도를 폐지하고 의약품 시판 후 안전관리제도를 위해성 관리제도로 통합하는 내용으로 「약사법」 이 개정(법률 제20328호, 2024.2.20 공포, 2025.2.21 시행)됨에 따라 법률에서 위임된 사항과 그 시행에 필요한 사항을 정하는 한편, 의약품 제조 수입업체의 명칭 변경, 영업소 소재지 변경시 의약품 품목에 대한 변경을 별도로 신청하지 않아도 일괄 변경 허가 또는 변경신고한 것으로 처리할 수 있는 근거를 마련하려는 것임.
- 의약품 제조소 GMP 현장감시 수행 절차(공무원 지침서)
의약품 제조소 GMP 현장감시 수행 절차(공무원 지침서)를 개정하였으니 업무에 참고하시기 바랍니다.
1. 목적
이 지침은 의약품 제조소의 GMP 현장감시를 수행함에 있어 관련자의 역할과 책임, 시행, 후속조치 및 세부 처리절차 등을 정함으로서 업무의 정확성, 일관성 및 투명성을 확보하기 위한 것이다.
2. 배경
식품의약품안전처(지방처을 포함한다. 이하 '식약처'라고 한다)는 「약사법」, 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」, 「의약품 등의 안전에 관한 규칙」 (총리령), 「첨단바이오의약품 안전 및 지원에 관한 규칙」 (총리령) 등에 따라 GMP적용 의약품 제조업자의 준수사항 이행 여부 등을 조사하기 위하여 제조소 현장에 대한 약사감시를 실시하고 있다.
-
-
GMP 가이드라인
-
[FDA] Field Alert Report Submission: Questions and Answers Guidance for Industry
-
This guidance provides FDA's current thinking regarding the requirements for submission of field alert reports (FARs) by applicants of new drug applications (NDAs) and abbreviated new drug applications (ANDAs) and outlines FDA's recommendations for FAR submissions to help improve their consistency and relevancy. The guidance also addresses certain frequently asked questions.
-
[PIC/S] Good Practices for Data Management and Integrity in Regulated GMP/GDP Environments
-
PIC/S Participating Authorities regularly undertake inspections of manufacturers and distributors of Active Pharmaceutical Ingredient (API) and medicinal products in order to determine the level of compliance with Good Manufacturing Pratice (GMP) and Good Distribution Practice (GDP) principles. These inspections are commonly performed on-site however may be performed through the remote or off-site evaluation of documentary evidence, in which case the limitations of remote review of data should be comsidered.
-
-
ISPE 국내외 소식
[한글판] PHARMACEUTICAL ENGINEERING
September-October 2024 / Volume 44, Number 5
- FDA's 2011 Process Validation Guidance: 10 Years On
- Potency Measurements for Cellular and Gene Therapy Products
- Finding the Assurance in Computer Software Assurance
* 한글판 번역본은 10월중 국제회원 및 교육회원에게 정기 발송해 드립니다.
* ISPE KOREA 홈페이지-출판물-매거진에서도 확인하실수 있습니다.
[정기교육] 데이터 완전성 최신 Trend
2024.09.26 (09:00~16:00)
* 교육강사: 이승훈과장 (워터스코리아)
* 교육내용
- 최신규정 총정리
- ISPE GAMPS5 Second Edition 변경사항
- Critical Thinking Risk-based approach 적응방법
- CSV 완료후 Operational Phase에서의 필요활동
- Workshop, Discussion
- US FDA Warning Letter가 주는 교훈
* 교육장소: 판교글로벌 R&D센터 A동 5층
* 기타 자세한 내용은 홈페이지(www.ispe.or.kr)에서 확인하실수 있습니다.
ISPE KOREA 교육회원 모집
* 가입대상: 제약 및 Biopharma 관련업계 종사하는 모든 분
* 회원혜택
- 한글판 Pharmaceutical Engineering 열람 및 다운로드
- 온라인 & 오프라인 교육비 40% 할인
- 동영상 교육자료 무료시청
* 가입방법: 홈페이지(www.ispe.or.kr) - 회원가입 - 교육회원 - 신청서 작성 - 회원가입비 납부
* 회원가입비: 연 25만원
-
Upcoming Conferences
2024 ISPE Annual Meeting & Expo
13-16 October 2024
Orlando, FL USA and Virtual
2024 ISPE Pharma 4.0 and Annex 1 Conference
10-11 December 2024
Rome, Italy and Virtual
-
Guidance Documents
Good Practice Guide: Unique ID of Glass Primary Containers
Published: May 2024
Page: 86
Member Price: $295.00
Non-Member Price: $595.00
Guide: 503A Compounding
Published: April 2024
Page: 72
Member Price: $95.00
Non-Member Price: $395.00
Guide: ATMPs - rAAV Comparability & Lifecycle Mgmt
Published: January 2024
Page: 98
Member Price: $395.00
Non-Member Price: $695.00
Guide: ATMPs - Allogeneic Cell Therapy
Published: January 2024
Page: 144
Member Price: $395.00
Non-Member Price: $695.00
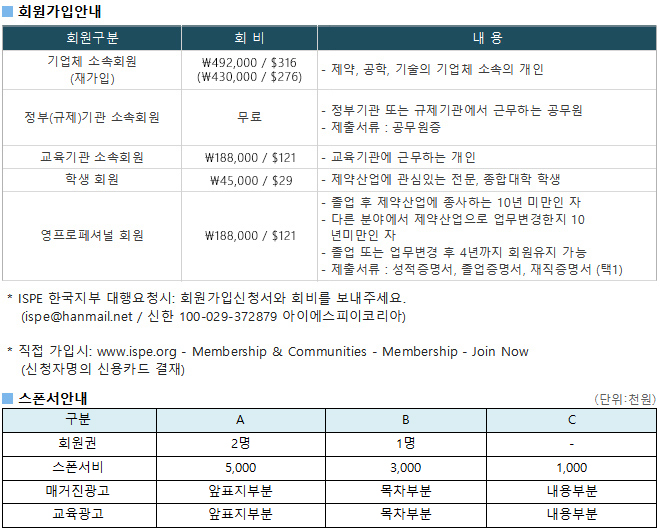
광고문의 TEL. 043-213-0442 E-MAIL. ispe@hanmail.net
ISPE Korea Affiliate | Office : 충북 청주시 흥덕구 직지대로 530, 702호 (송정동, 청주테크노S타워)
-
